Entenda mais sobre os medicamentos cruciais para o tratamento de muitas doenças raras.
Medicamentos órfãos são aqueles indicados para pacientes com doenças raras e que, como são utilizados por um pequeno número de pessoas, sua produção não é considerada lucrativa e, por isso, são caros e escassos.
Embora sejam de difícil acesso, são cruciais para esses pacientes, pois têm a função de tratar, atuar na prevenção de sintomas incapacitantes, atrasar a progressão da doença ou possibilitar sua remissão.
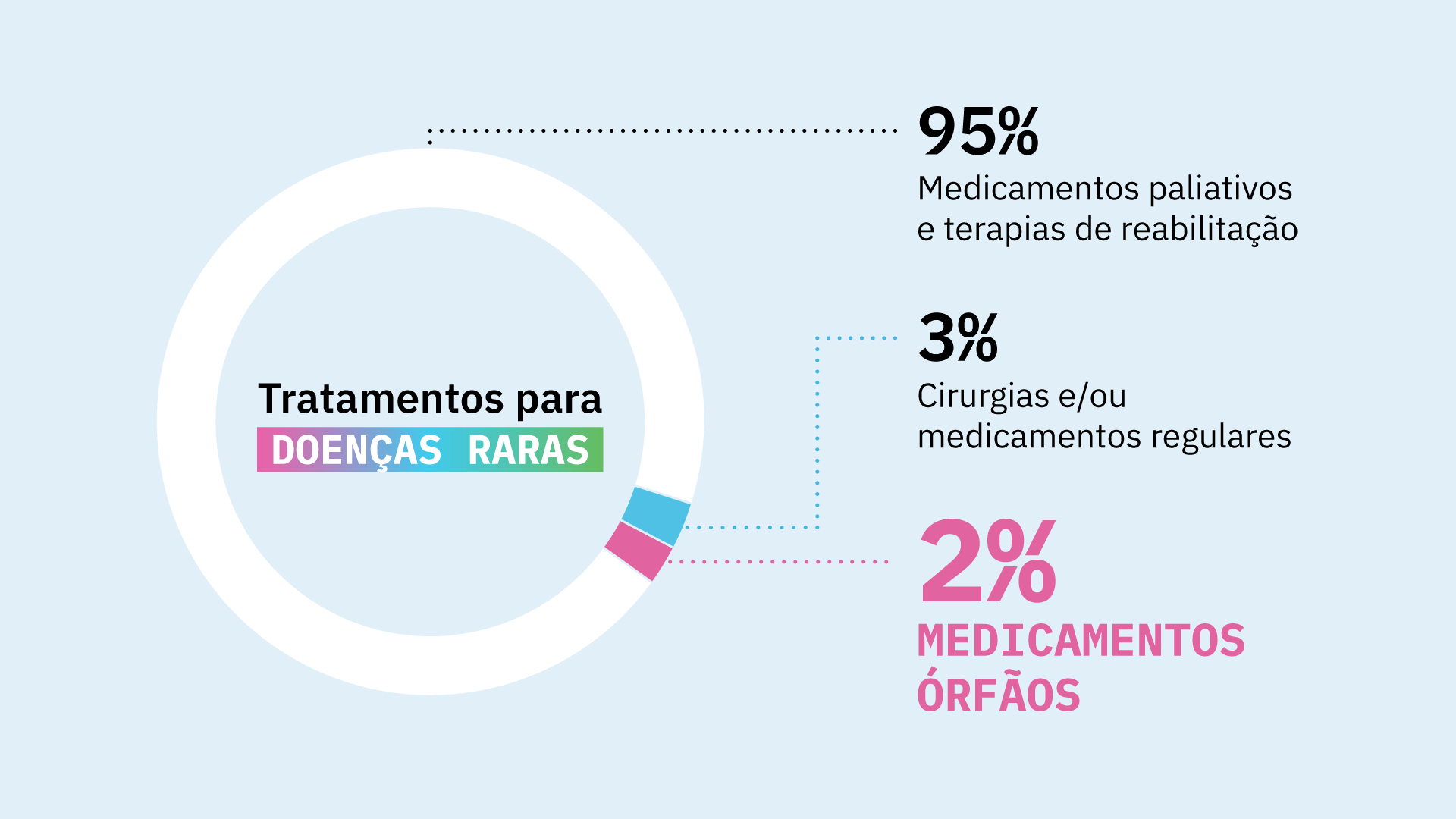
Estima-se que apenas 2% de todas doenças raras tenham pelo menos um tratamento órfão aprovado, segundo a Interfarma (Associação da Indústria Farmacêutica de Pesquisa).
Estima-se que 260 a 450 milhões de pessoas no mundo possuam uma doença rara, sendo mais de 13 milhões no Brasil.
| Desinteresse farmacêutico
Os portadores de doenças raras apresentam uma situação de desvantagem e fragilidade em relação aos portadores de doenças mais prevalentes, pois em virtude da baixa lucratividade dos medicamentos para doenças raras, empresas farmacêuticas não têm interesse em investir na pesquisa e no desenvolvimento desses remédios. E, uma vez produzidos, os medicamentos órfãos possuem um custo elevado, tornando-se inacessíveis para seu público-alvo. |
Medicamentos órfãos: Incentivo ao desenvolvimento
Existem mais de 6.000 doenças raras descritas. Embora centenas delas sejam bem estudadas e caracterizadas e, hoje, possuam tratamento disponível ou em fase de desenvolvimento, o desenvolvimento de tratamentos para doenças raras enfrenta grandes obstáculos, não só pelo grande espectro de sinais e sintomas de uma enfermidade rara (mesmo entre os pacientes com a mesma condição), mas também pelo investimento necessário para a elaboração das pesquisas ser elevado.
Leis relativas a medicamentos órfãos têm o objetivo de proporcionar incentivos para que as companhias farmacêuticas desenvolvam e comercializem medicamentos para o tratamento das doenças raras.
Nesse contexto, os Estados Unidos foram os pioneiros na promoção, desenvolvimento e visibilidade dessas drogas através do Ato dos Medicamentos Órfãos (Orphan Drug Act) instituído pela organização governamental americana FDA (Food and Drug Administration) em 1983. O documento caracterizou medicamento órfão como aquele que trate doenças que afetem menos de 200.000 americanos e criou as seguintes facilitações para a sua produção:
- Exclusividade de mercado: Garantia de que medicamentos semelhantes produzidos pela concorrência não possam ser comercializados por determinado período (10 – 12 anos) após a autorização de introdução no mercado.
- Aconselhamento científico aos protocolos experimentais: Consultoria especializada na regulamentação de testes e ensaios clínicos necessários ao desenvolvimento de medicamentos.
- Redução de taxas: Isenções de taxas para a designação de medicamentos órfãos e reduções nas taxas de autorização de introdução no mercado e de inspeções.
Posteriormente, outros países seguiram o exemplo dos Estados Unidos e também criaram leis de incentivo à produção de medicamentos órfãos, como Singapura (1991), Japão (1993), Canadá (1996), Austrália (1997) e União Europeia (1999).
Em 2021, os desenvolvedores de medicamentos investiram um total de US$ 22,9 bilhões em pesquisas sobre doenças raras, um aumento de 28% em comparação com 2020.
Medicamentos órfãos: cenário brasileiro
A definição de doença rara varia de país para país. Segundo o Ministério da Saúde brasileiro, uma doença é considerada rara quando atinge no máximo 65 pessoas a cada 100.000 indivíduos.
Há menos de 10 anos o Brasil passou a desenvolver políticas públicas dirigidas especificamente ao fornecimento de medicamentos e outras ações de saúde para pessoas com doenças raras.
O Ministério da Saúde instituiu a Política Nacional de Atenção Integral às Pessoas com Doenças Raras em 2014 e aprovou as Diretrizes que visam a incorporação e uso de tecnologias voltadas para a promoção, prevenção e cuidado integral de doenças raras, incluindo o tratamento medicamentoso.
Medicamentos para doenças raras
As determinações do Ministério da Saúde até aquele momento, embora permitissem a incorporação de tratamentos de saúde destinados a doenças raras, não apresentavam objetivos claros quanto aos cuidados a pessoas com essas condições.
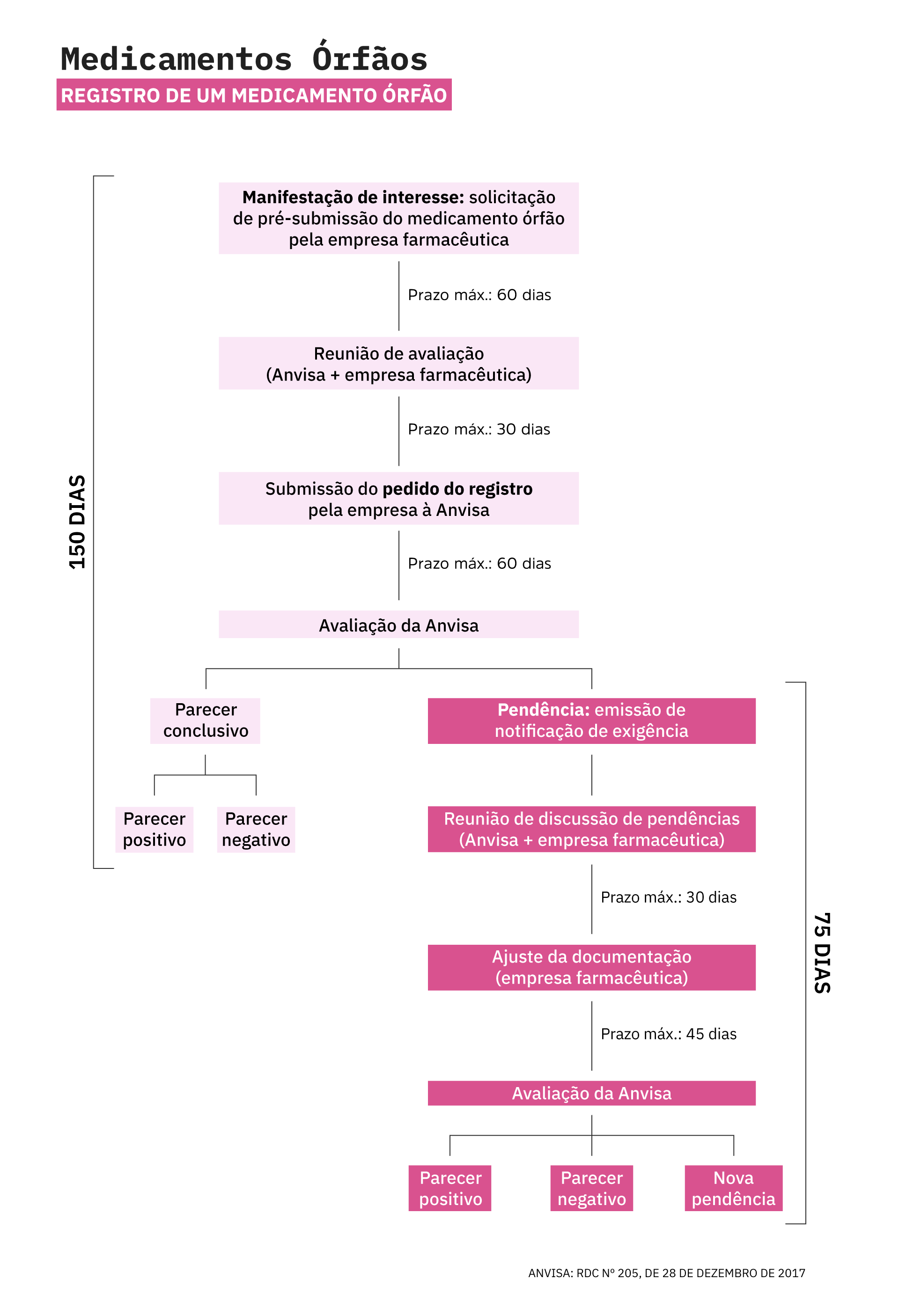
Desde então, a Agência Nacional de Vigilância Sanitária (Anvisa) instituiu Resoluções da Diretoria Colegiada (RDC) para fomentar a pesquisa e a distribuição de medicamentos órfãos. Dentre elas, as RDCs n° 205/2017 e nº 260/2018 são consideradas marcos regulatórios na área, uma vez que regulamentam a aprovação de medicamentos órfãos e ensaios clínicos no Brasil.
De acordo com as normas vigentes, o prazo mínimo para o registro de um medicamento órfão no Brasil é de 150 dias, considerando que a Anvisa não solicite esclarecimentos adicionais à empresa farmacêutica. No caso de medicamentos já registrados em outros países, o prazo de registro no Brasil pode ser reduzido quando for apresentado o relatório técnico de avaliação do produto, emitido pelas respectivas autoridades reguladoras.
A edição de normas regulatórias é um importante passo para o aumento de medicamentos órfãos registrados e de pesquisas clínicas no país. Contudo, a existência de instrumentos regulatórios não garante a incorporação no Sistema Único de Saúde (SUS). Para garantir o acesso público, os medicamentos precisam passar por um processo de Avaliação de Tecnologia em Saúde conduzido pela Comissão Nacional de Incorporação de Tecnologias no SUS.
Ensaios clínicos para doenças raras
Aproximadamente 80% das doenças raras têm origem genética e podem ser passadas de uma geração para outra. Assim, a compreensão das bases moleculares das doenças genéticas raras é particularmente importante para compreender os diferentes sintomas e quadros de gravidades, bem como desenvolver terapias específicas para o seu tratamento.
Nesse contexto, os estudos clínicos desempenham um papel primordial no tratamento de doenças raras.
| O que são ensaios clínicos
Ensaios clínicos são estudos médicos que ajudam a encontrar novas maneiras de prevenir, detectar ou tratar doenças. Eles são realizados em pessoas, após uma avaliação cuidadosa de resultados obtidos em testes prévios in vitro e em animais (estudos pré-clínicos) e do seu plano de ação (protocolo). |
A participação de pacientes com doenças raras em ensaios clínicos de novos medicamentos é outra forma de ter acesso a novas terapias.
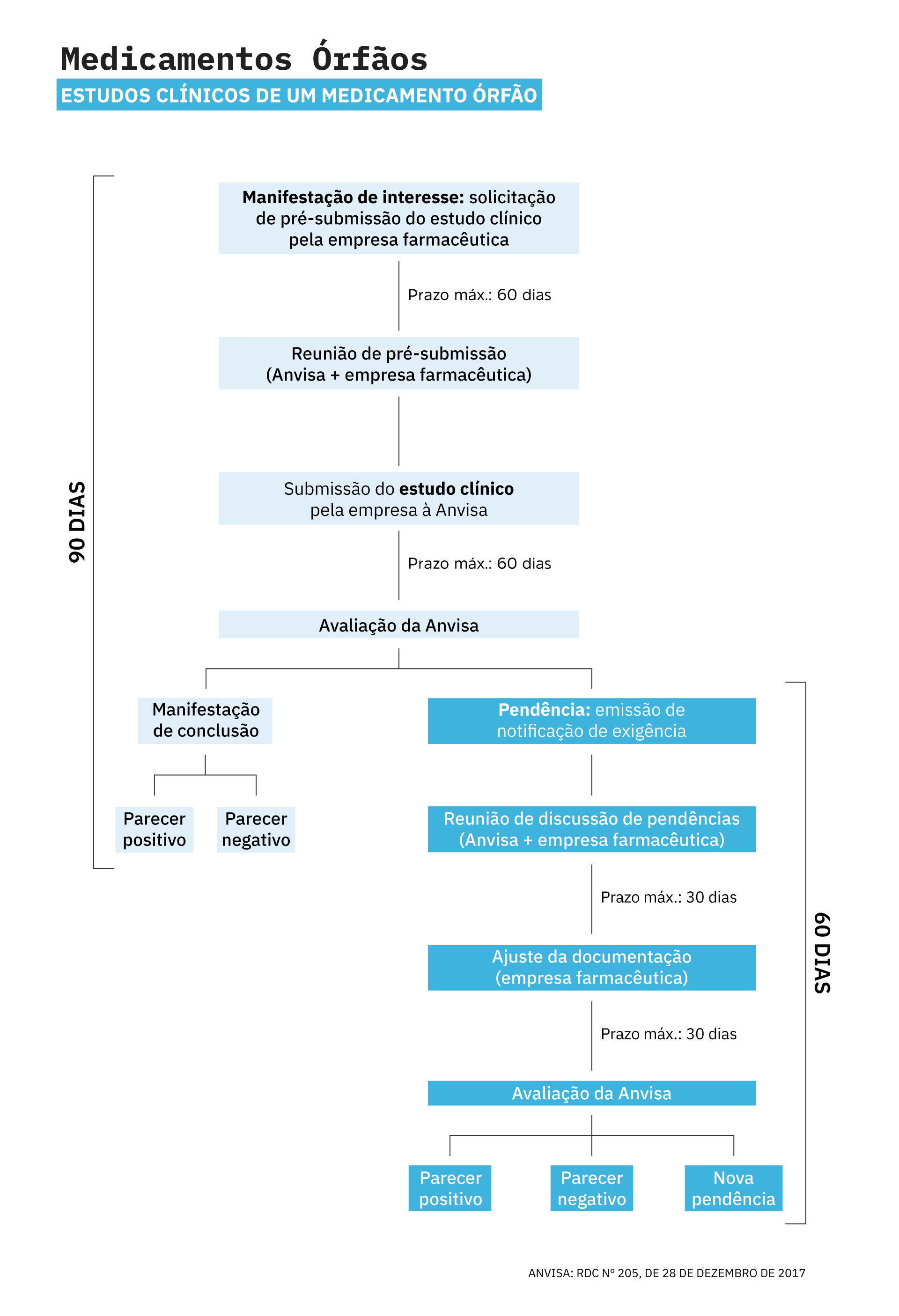
Nesse cenário, a legislação estabelece que indústrias farmacêuticas devem manifestar interesse na condução do estudo junto à Anvisa. Após essa etapa, o prazo mínimo de avaliação e aprovação do estudo é de 90 dias. Caso o pedido de autorização não cumpra integralmente com os requisitos previstos na legislação, o prazo pode se estender por no mínimo mais 60 dias.
Novos horizontes
As ações governamentais deram bons resultados em 2019, ano que houve um recorde na aprovação de medicamentos: foram 21, entre sintéticos, biológicos e específicos. Além disso, foi admitida a realização de 30 ensaios clínicos no Brasil.
| Conheça alguns medicamentos para doenças raras aprovados no Brasil :
Ataluren: É indicado para o tratamento da distrofia muscular de Duchenne, doença que provoca fraqueza muscular, resultante de mutações no gene da distrofina (DMD). O medicamento tem efeito para mutações sem sentido (mutação nonsense) e é capaz de retardar a evolução da doença em até 2 anos.
Ivacaftor: É indicado para o tratamento da fibrose cística (FC), doença causada por mutações no gene CFTR e caracterizada pela produção de um muco espesso que afeta o funcionamento de múltiplos órgãos, principalmente os pulmões e o pâncreas. Os pacientes que têm algumas mutações específicas no gene CFTR e podem ser tratados com o Ivacaftor apresentam um funcionamento regulado da proteína CFTR, minimizando os sintomas e aumentando a sobrevida.
Betaína anidra: É indicado no tratamento da homocistinúria, envolvendo deficiências ou defeitos nas enzimas cistationina beta-sintetase (CBS), 5,10-metileno-tetrahidrofolato redutase (MTHFR) e cofator do metabolismo de cobalamina. Também pode ser utilizado como complemento de outras terapias, tais como vitamina B6 (piridoxina), vitamina B12 (cobalamina), folatos e uma dieta específica.
Crizanlizumabe: É indicado para reduzir a frequência de crises vaso-oclusivas ou crises de dor em pacientes com anemia falciforme, doença caracterizada pelas hemácias em forma de foice causada por mutações no gene HBB.
Nusinersena: É uma terapia gênica indicada para o tratamento da atrofia muscular espinhal (AME), uma doença neuromuscular que afeta os neurônios motores da medula espinhal e do tronco cerebral. A terapia ajuda o organismo a produzir mais proteínas SMN a partir do gene SMN2, retardando os sintomas da doença e melhorando o estado geral do paciente.
Antes de tratar é preciso detectar: Teste da Bochechinha
Não há dúvidas da importância do tratamento para a qualidade de vida de pessoas portadoras de doenças raras, contudo, a detecção precoce é o primeiro passo para evitar a progressão.
O Teste da Bochechinha é uma triagem neonatal genética, ou seja, ele analisa o DNA do bebê em busca de mutações que estão relacionadas ao desenvolvimento de mais de 340 doenças raras, incluindo a análise de distrofia muscular de Duchenne e fibrose cística.
Dentre as 340 doenças analisadas pelo Teste da Bochechinha, mais de 175 condições são tratadas com medicamentos, de forma isolada ou em combinação com outras intervenções.
Embora muitas doenças raras não tenham cura, todas as condições incluídas no Teste da Bochechinha possuem tratamentos para melhorar a qualidade de vida do bebê. O teste pode ser realizado desde o primeiro dia de vida, antes mesmo de qualquer sintoma aparecer e é feito com uma amostra de saliva.
Conheça o Teste da Bochechinha.
Revisão |
| O que são medicamentos órfãos?
Medicamentos órfãos são aqueles indicados para pacientes com doenças raras e que, como são utilizados por um pequeno número de pessoas, sua produção não é considerada lucrativa e, por isso, são caros e escassos. Estes medicamentos são cruciais para esses pacientes, pois têm a função de tratar, atuar na prevenção de sintomas incapacitantes, atrasar a progressão da doença ou possibilitar sua remissão. Quais os marcos regulatórios dos medicamentos órfãos no Brasil? As Resoluções da Diretoria Colegiada (RDC) n° 205/2017 e nº 260/2018 são consideradas marcos regulatórios na área, uma vez que regulamentam a aprovação de medicamentos órfãos e ensaios clínicos no Brasil. O que são ensaios clínicos? Ensaios clínicos são estudos médicos que ajudam a encontrar novas maneiras de prevenir, detectar ou tratar doenças. Eles são realizados em pessoas, após uma avaliação cuidadosa de resultados obtidos em testes prévios in vitro e em animais (estudos pré-clínicos) e do seu plano de ação (protocolo). |
Referências:
EURODIS: Promoção do desenvolvimento de medicamentos órfãos
FDA- Designating an Orphan Product: Drugs and Biological Products
ANVISA: Resolução da Diretoria Colegiada (RDC) n° 205/2017
ANVISA: Resolução da Diretoria Colegiada (RDC) nº 260/2018
ANVISA: Doenças raras: saiba como é o registro de medicamentos
ANVISA: Recorde de medicamentos aprovados para doenças raras
Developing Products for Rare Diseases & Conditions. Food and Drug Administration.
Rare Disease Cures Accelerator. Food and Drug Administration.
The Lancet Neurology. Rare diseases: maintaining momentum. Lancet Neurol. 2022;21(3):203. doi:10.1016/S1474-4422(22)00046-1
0 comentários